AMPure XP
Ещё в 1971 году было отмечено увеличение скорости седиментации ДНК фага Т4 в растворах с высокой концентрацией полиэтиленгликоля (ПЭГ) и NaCl /1/. В 1975 году была показана возможность фракционирования ДНК по молекулярной массе осаждением при разных концентрациях ПЭГ, и изучено влияние на этот процесс нескольких факторов /2/. Одним из недостатков такого осаждения были значительные потери ДНК при её низкой исходной концентрации /3/. Устранить влияние концентрации и сделать осаждение ДНК ПЭГом наиболее удобным способом её очистки позволило применение магносорбентов.
Способ очистки и выделения ДНК с применением магнитных частиц был запатентован в 1994 году /4/. В том же году была опубликована статья с описанием этого способа, обозначенного аббревиатурой SPRI (Solid-Phase Reversible Immobilisation) /5/. Коммерциализацией данной технологии занялась компания Agencourt, приобретённая впоследствии корпорацией Beckman Coulter. В результате каталог последней пополнился дюжиной наборов для выделения ДНК (Agencourt AMPure XP; Agencourt CleanSEQ ; SPRIselect и т.п.), пользующихся заслуженной популярностью. Все они "разливаются из одной бочки", но это не главное. Главное - это высокая цена, которая далеко не всем кажется справедливой. Тем более, что срок действия защищающего этот способ очистки ДНК патента давно истёк, а приготовить солевой (2,5М NaCl) раствор ПЭГ 8000 (20%), содержащий 0,1% карбоксилированных магнитных частиц, совсем не сложно. Правда, возможны некоторые варианты этого метода (1,6М NaCl + 13% ПЭГ 8000; ПЭГ 6000 вместо ПЭГ 8000; силикатные частицы вместо карбоксильных и т.п.), что немного меняет протокол очистки ДНК, но не меняет суть дела. В результате появились конкуренты, предлагающие сравнительно дешёвые аналогичные наборы.

- AMPure XP: 5ml - 305$; 60ml - 1140$; 450ml - 5600$
- SPRIselect: 5ml - 345$; 60ml - 1290$; 450ml - 6200$
- AxyPrep™ Mag PCR Clean-Up: 5ml - 157.50$; 50ml - 708.75$; 250ml - 2362.50$
- AxyPrep™ Mag FragmentSelect: 5ml - 189.00$
- PCRClean DX: 5ml - 98.00$; 50ml - 575$; 250ml - 2465$
- DNA SizeSelector-I: 5ml - 125.00$; 50ml - 695$; 250ml - 2395$
- MCMag™ Library Purification Kit: 5ml - 250.00$; 60 ml - 935$; 450ml - 4648$
- AmpliClean™: 5ml (+ magnetic stand) - 359€ (now 199€)
К конкурентам можно причислить и компанию Life Thechnologies, постеснявшуюся "передрать" патентованный метод. В её наборах для осаждения ДНК используется не ПЭГ, а изопропиловый спирт.
- MagJET Plasmid DNA Kit
- MagJET Genomic DNA Purification Kits
- MagJET RNA Purification Kits
- MagJET Viral DNA and RNA Purification Kits
- MagJET mRNA Enrichment Kit
- MagJET NGS Cleanup and Site Selection Kit
Ещё один тип конкурентов - поставщики карбоксилированных магнитных частиц. Смешать их с растворами ПЭГ собственного приготовления совсем не сложно. А можно и не смешивать. Например, в 2010 году было описано приготовление библиотек ДНК, в котором использовались растворы ПЭГ 6000 различной концентрации в 0,9М NaCl и готовая суспензия карбоксильных частиц MyOne™ (Invitrogene/Dynal) /6/. Более удобный вариант приготовления библиотек для NGS был описан в 2011 году /7/. Авторы этой работы предложили все этапы обработки ДНК проводить в одной пробирке, в которой меняются только растворы. Одни и те же магнитные частицы остаются в пробирке на всех стадиях приготовления библиотек ДНК, и удаляются только на последней стадии - перед проведением ПЦР или гибридизационым таргетированием.
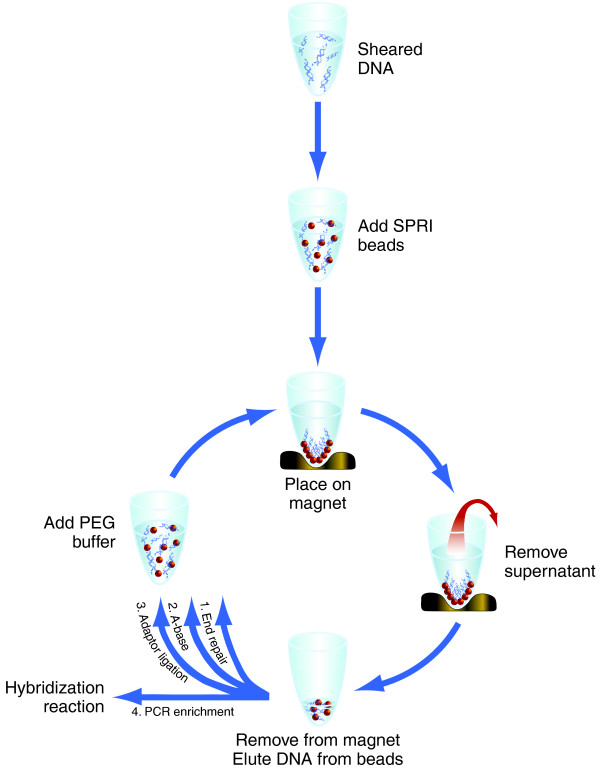
Отсюда следует, что для обычной очистки ДНК проще всего использовать дешёвый аналог AMPure XP (Ampure RU), т.е. готовую смесь карбоксилированных магночастиц с солевым раствором ПЭГ. Что касается приготовления библиотек для NGS, то "суп" (раствор ПЭГа) и "мухи" (магночастицы) желательно подавать отдельно. Исходя из этого в нашем каталоге должны значиться по крайней мере 3 наименования - Ampure RU (готовая смесь), карбоксимагнетит (магносорбент, 1%) и раствор ПЭГ (20% ПЭГ 8000, 2,5М NaCl).
Разработка технологии получения килограммовых количеств карбоксильного магносорбента, завершена. Точнее - в целом эта технология была готова давно, но много времени потребовало увеличение их размеров до 1,5...2 мкм и повышение монодисперсности частиц. Дело в том, что субмикронные частицы после осаждения ДНК плохо ресуспендируются. Это стало серьёзной проблемой при работе с первыми наборами AMPure, из-за чего компания Agencourt была вынуждена увеличить средний диаметр частиц с 0,6 до 1,5 мкм и переименовать свои наборы в AMPure XP. Чтобы не наступать на их "грабли" пришлось основательно повозиться с калибровкой размеров частиц.
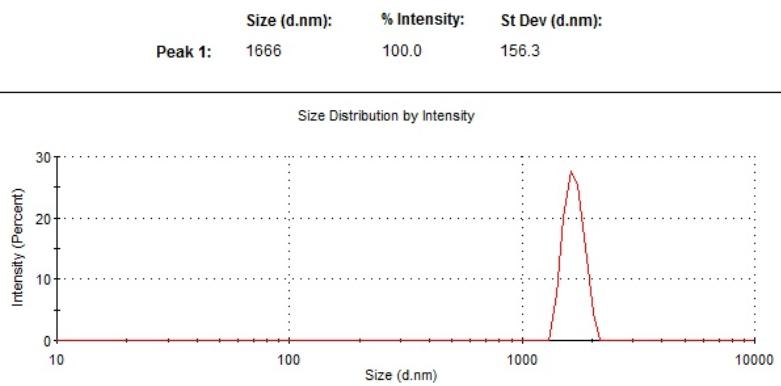
Измерение размеров (диаметра) карбоксилированных частиц проводилось с использованием Dynamic Light Scattering на приборе Zetasizer Nano ZS (Malvern Instruments Ltd., UK).
Ещё одни "грабли" приходится учитывать при работе с ПЭГ. Дело в том, что водные растворы этого полимера быстро окисляются. В них образуется муравьиная кислота, формальдегид, ацетальдегид и прочие нехорошие примеси /8, 9/. Из-за этого для приготовления "самодельных" растворов необходимо использовать только особо чистый ПЭГ, и всё равно долго они не хранятся. Для устранения этой проблемы используют различные антиоксиданты /8/, высокие концентрации 2-меркаптоэтанола /10/ и прочие добавки. Именно они обеспечивают сравнительно высокую стабильность "фирменных" наборов, а их отсутствие обеспечивает головную боль неопытным экспериментаторам. Поэтому первоочередной задачей является разработка рецептуры раствора ПЭГ, способного выдерживать длительное хранение.
- Lerman LS (1971) A transition to a compact form of DNA in polymer solutions. Proc Natl Acad Sci U S A 68:1886–1890 (pdf).
- Lis JT, Schleif R (1975) Size fractionation of double-stranded DNA by precipitation with polyethylene glycol. Nucleic Acids Res 2:383–390 (pdf).
- Paithankar KR, Prasad KS (1991) Precipitation of DNA by polyethylene glycol and ethanol. Nucleic Acids Res 19(6):1346 (pdf).
- US Pat.5705628.
- Hawkins TL, O'Connor-Morin T, Roy A, Santillan C (1994) DNA purification and isolation using a solid-phase. Nucleic Acids Res. 1994 Oct 25;22(21):4543-4 (pdf).
- Lundin S, Stranneheim H, Pettersson E, Klevebring D, Lundeberg J. (2010) Increased throughput by parallelization of library preparation for massive sequencing. PLoS One. 2010 Apr 6;5(4):e10029 (pdf).
- Fisher S, Barry A, Abreu J et al. (2011) A scalable, fully automated process for construction of sequence-ready human exome targeted capture libraries. Genome Biol. 2011;12(1):R1. (pdf).
- Hemenway JN, Carvalho TC, Rao VM et al. (2012) Formation of reactive impurities in aqueous and neat polyethylene glycol 400 and effects of antioxidants and oxidation inducers. J Pharm Sci. 2012 Sep;101(9):3305-18 (Ref.).
- Hildebrandt C, Joos L, Saedler R, Winter G (2015) The "New Polyethylene Glycol Dilemma": Polyethylene Glycol Impurities and Their Paradox Role in mAb Crystallization. J Pharm Sci. 2015 Jun;104(6):1938-45 (Ref.).
- Vasilevskaya VV, Khokhlov AR, Matsuzawa Y, Yoshikawa K. (1995) Collapse of single DNA molecule in poly(ethylene glycol) solutions. J. Chem. Phys. 102, 6595-6602 (pdf).
Некоторые подробности и особенности очистки ДНК при помощи AMPure XP обсуждались на сайте seqanswers.com: http://seqanswers.com/forums/showthread.php?t=3752




